Licenciamiento de biomoléculas con efectos inmunológicos: desde un alacrán morelense a la industria farmaceútica global
Mario Trejo Loyo
Tecnologías para la salud en proceso...
Uno de los investigadores más productivos en la historia del Instituto de Biotecnología de la Universidad Nacional Autónoma de México es el Dr. Lourival Domingos Possani Postay, quien cuenta con muchas publicaciones científicas y también, un gran número de registros de patentes de invención; más de la mitad de ellas ya concedidas. El Dr. Possani y su grupo de investigación han generado aportaciones muy significativas al conocimiento del veneno de los alacranes lo que le ha valido el reconocimiento de la comunidad científica internacional. Hoy día, los resultados de su trabajo científico y tecnológico han dado lugar entre otros productos, a la generación de anti-venenos altamente eficientes. Sin embargo, en esta historia hablaremos sobre otro de sus mayores logros: la generación de pequeñas proteínas con capacidades fisiológicas inmuno-regulatorias.
A partir del veneno de un alacrán morelense ‘barranqueño’ (nombre científico: Vaejovis mexicanus smithi), el grupo del Dr. Possani descubrió un par de toxinas similares pero cuya estructura era muy diferente a la de los dos grandes grupos de toxinas con las que habitualmente habían trabajado hasta entonces. Durante su carrera académica y dada su amplia trayectoria y su reconocimiento global como líder en el campo de la toxicología de animales ponzoñosos —acababa de recibir el doctorado honoris causa de la Universidad de Debrecen, Hungría—, el Dr. Possani había establecido una estrecha colaboración con un grupo de investigación de dicha universidad que tenía capacidades técnicas complementarias para llevar a cabo estudios electro·fisiológicos in vitro de componentes de los venenos. Con estos experimentos se explican con precisión sus efectos disruptivos o moduladores en fenómenos nerviosos, musculares o — como veremos aquí— inmunológicos. A partir de estudios iniciales, se descubrió que un par de las toxinas identificadas en este alacrán morelense interactuaban de manera específica con una proteína presente en las membranas celulares de los linfocitos (glóbulos blancos), los que son esenciales para activar/ desactivar la respuesta inmune en mamíferos [1, 2]. Este hallazgo llevó a la idea de considerarlas como potenciales moléculas inmunomoduladoras.
El salto del descubrimiento científico a una aplicación práctica
Con estos resultados, el grupo del Dr. Possani procedió a llevar a cabo evaluaciones con animales vivos. Para disponer de un modelo adecuado se utilizó un procedimiento antigénico para inducir en un grupo de ratas, una condición autoinmune temporal conocida como Hipersensibilidad Tipo Retrasada o Tardía (DTH por sus siglas en inglés), la cual provoca una inflamación en las orejas de la rata [3]. A una mitad del grupo de ‘ratas orejonas’ [Fig. 1-E], se les inyectó una dosis de evaluación de una solución conteniendo una de las toxinas (10 µg) y a la otra mitad (controles negativos), sólo la solución con agua destilada. Al cabo de unas horas, la inflamación de las orejas en el grupo tratado con la toxina se redujo de manera muy significativa en comparación con el grupo control. Resultados similares se obtuvieron al inyectar la segunda toxina. Esta era la ‘prueba de concepto’ de la invención, a la que seguirían otras etapas hacia una posible aplicación terapéutica para padecimientos autoinmunes (esclerosis múltiple, diabetes tipo II, artritis, etc.). El proceso subsiguiente: proteger y continuar con desarrollo formal de un medicamento, se muestra en la figura 1.
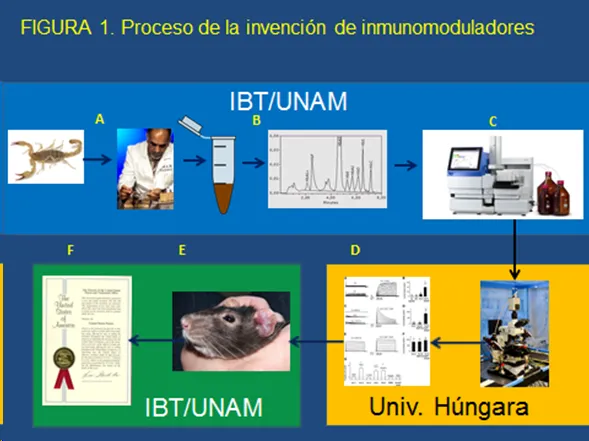
Figura 1.
El hecho de que ambas toxinas del alacrán barranqueño fueran capaces de suprimir la inflamación causada por un desajuste en la respuesta inmune en ratas, confirmó su potencial como moléculas inmunomoduladoras, y haberlas aislado y caracterizado se considera un aporte original cuyos Derechos de Propiedad Intelectual, pueden ser protegidos por un tiempo suficiente para asegurar el uso o destino comercial exclusivo que determinen sus propietarios.
El arte de proteger los derechos de propiedad industrial de una invención
Una invención pertenece a su creador(es), o bien, al empleador de éste/os, siempre y cuando estén formal y oficialmente protegidos sus Derechos de Propiedad Intelectual (DPI). Por esta razón, el Dr. Possani acudió a la Secretaría Técnica de Gestión y Transferencia Tecnológica (STGTT a cargo del autor), para auxiliarlo con la solicitud de patente: “Mario —me dijo— este es el trabajo más importante de mi vida, y será muy importante que se registre como solicitud de patente internacional — bajo el Patent Cooperation Treaty o PCT— para que lo conozcan directamente las empresas interesadas en este tipo de moléculas”. Fue todo un reto personal que dicha patente fuera redactada en inglés para someterla al Buró Internacional de la Organización Mundial de la Propiedad Intelectual (OMPI/ WIPO), con sede en Berna, Suiza, la cual quedó registrada desde el 15 de mayo de 2007. La solicitud constó de 82 páginas [4] donde se proponía la protección a las dos toxinas como moléculas inmunomoduladoras, así como de una versión consenso de ambas moléculas (una secuencia común promedio); se incluyeron en ella todos los métodos implementados para su caracterización y, especialmente, su uso para el tratamiento de enfermedades autoinmunes y en la prevención del rechazo de órganos. También se planteaba reivindicar la protección a las posibles composiciones farmacéuticas basadas en estas moléculas, así como a los métodos cualitativos y cuantitativos para detectar la presencia de la ‘proteína-blanco’ (unos canales iónicos denominados Kv1.3), en las células. En la actualidad, la patente ya ha sido otorgada en 14 de los países y regiones en donde se continuó gestionando esta solicitud como fases nacionales de la solicitud internacional [Fig. 2]. Pero volvamos a donde estábamos…

Figura 2.
El contacto con la empresa y la verificación científica
Aún con la patente ‘en trámite’, iniciamos un plan para impulsar su aprovechamiento, que podía ser a través de diferentes estrategias. En los siguientes meses contactamos con una empresa mexicana cuyo trabajo se relaciona con venenos de alacranes, aunque finalmente no mostró interés en licenciarla. Luego, a mediados de noviembre de 2008, la solicitud internacional de patente fue publicada por la OMPI como parte del procedimiento para su otorgamiento y, tal como predijo el Dr. Possani, esto permitió que una empresa europea, interesada en este tipo de moléculas, se enterara del contenido de la publicación y nos contactara. El primer acercamiento por correo-e de esta segunda empresa con el Dr. Possani fue en marzo de 2009; le manifestaron interés por conocer más detalles de su invención, lo que llevó a la firma de un acuerdo bilateral de confidencialidad entre UNAM y esa entidad privada. Se organizaron posteriormente intercambios vía teleconferencia —mucho antes del Zoom-boom motivado por la pandemia—, entre el grupo del Dr. Possani y el equipo científico de la empresa, para presentar los datos experimentales obtenidos. Para julio del mismo año, la empresa solicitó formalmente realizar una visita al Instituto de Biotecnología a fin de revisar a detalle todo lo concerniente a la investigación (a nivel de bitácoras y equipamiento de laboratorio); una vez en Cuernavaca, el equipo directivo de I&D de la empresa corroboró su interés por ambas toxinas y además, nos explicó cómo funciona su modelo de negocios.
Unas semanas más tarde, nos contactó el equipo financiero de la empresa; todo indicaba que el equipo científico había quedado satisfecho y pasó la estafeta a ese departamento y no volvió a participar por un buen tiempo. Lo relevante entonces fueron una serie de preguntas para llevar a cabo su evaluación de factibilidad para la adquisición de la licencia de la tecnología. Querían saber si había otras solicitudes de patente de productos relacionados; si la solicitud pertenecía a la UNAM o a los inventores —se han publicado artículos sobre el estatus jurídico de éste y de otros casos (ver BiotecMov Núms. 7, 10, 13, 21 y 25, y Ref. 5)—; también si participaron co-inventores de alguna otra institución, si había acuerdos respecto de la propiedad y finalmente, sobre el manejo de las solicitudes.
Todas estas preguntas contribuyen a determinar si al adquirir una licencia no se generan ambigüedades o compromisos complicados. Para dejarlo claro, se les explicó que la Ley Federal del Trabajo en México estipula que las invenciones pertenecen al ‘patrón’ o empleador (en este caso la UNAM), quien estaría obligado a retribuir a sus empleados creadores de alguna invención, ciertas utilidades (regalías); así como que la UNAM cuenta con un reglamento interno que establece cómo debe ser esta retribución (actualmente, el 50% de los ingresos por explotación de tecnologías universitarias va a manos de los académicos inventores). Finalmente se aclaró que con los co-inventores húngaros se había firmado un acuerdo de cesión de derechos a favor de la UNAM y que se les retribuiría por ello, por lo que la única persona (moral) con intereses en la invención y la solicitud de patente era la UNAM.
Mientras tanto, el equipo científico de la empresa —siguiendo la descripción de la solicitud de patente aún sin infringirla, pues no era para fines comerciales— sintetizó químicamente una de las dos toxinas descritas, y reprodujeron los resultados descritos en la solicitud y, para fines comparativos, requerían obtener una muestra de la toxina sintetizada originalmente en México. Por ello, se firmó un convenio de transferencia de materiales biológicos (otro recurso formal para la trazabilidad y transparencia en la gestión del conocimiento); este instrumento establece un marco legal para el libre intercambio de muestras biológicas, de forma segura sobre todo para quien proporciona el material. La muestra fue enviada y así podían cotejar y corroborar los efectos de las versiones europea y mexicana de la molécula.
Entrada a ‘fases nacionales’ de la solicitud de patente
El equipo financiero preparaba lo que se conoce como “Hoja de términos”, donde se establecen las principales condiciones para negociar un convenio (incluyendo las económico-administrativas), cuando nos inquirieron sobre la fecha de entrada a ‘fases nacionales’ de nuestra solicitud internacional de patente, y en qué países teníamos contemplado registrar dichas fases nacionales. Esta pregunta nos llevó a discutir y establecer una lista de 8 países y una región del mundo (Europa), que consideramos estratégicos para extender nuestra solicitud de patente. En su respuesta a la consulta respectiva, la empresa solicitó que se incluyeran, además, 5 países que no habíamos contemplado (que comprenden una región más, Eurasia). Sin embargo, el tono del mensaje sugería que la UNAM debía cubrir este gasto.
Los siguientes fueron días de mucha tensión: habíamos encontrado a una empresa muy interesada en nuestra tecnología, sin saber aún qué monto estarían dispuestos a pagar por ella; por otro lado tendríamos que realizar a corto plazo un pago muy elevado (alrededor de 100 mil U$D), para proseguir con la solicitud de patente en fases nacionales en 13 países y 2 regiones del mundo. Esta suma no estaba disponible en el IBt y las autoridades de la UNAM explicaron que no se tenían fondos reservados para este tipo de gastos.
Para subsanar este nuevo obstáculo, consideramos diversas posibilidades que incluían, desde la participación financiera por parte de los inventores, hasta la búsqueda de socios emprendedores (externos), dispuestos a contribuir con el monto total. Esto último implicaría un porcentaje de participación en el arreglo con la empresa, ignorando si la UNAM, como eventual titular de los DPI, estaría dispuesta a ceder tal porcentaje.
En ese momento la empresa interesada nos contactó de nuevo, indagando sobre nuestros recursos financieros para continuar con el proceso de patentamiento y, ante cierto titubeo nos hizo una atractiva propuesta. En vista de que su equipo científico ya había corroborado los hallazgos descritos en nuestra solicitud —además de que sus especialistas en propiedad industrial habían revisado a detalle la solicitud de patente— habían considerado altamente probable que sería otorgada en los diferentes países; ante la necesidad de que la solicitud continuara hacia las fases nacionales, la empresa nos propuso cubrir ese gasto aún y cuando no teníamos firmado todavía un Convenio de Licencia.
Para realizar esto de forma expedita, firmamos una ‘carta de intención’ donde la empresa se comprometía a cubrir los gastos de entrada para el patentamiento en las fases nacionales en 13 países y dos regiones del mundo, y nosotros, a contratar un despacho mexicano capacitado y con corresponsales en las jurisdicciones respectivas, para gestionar la entrada en todos esos sitios; en la carta se contempló que, inclusive, los gastos del despacho serían directamente pagados por la empresa. Otros acuerdos en el documento asentaban que, en caso de que no se llegara a firmar el Convenio de Licencia con esta empresa, pero sí con otra, se reembolsarían los gastos de entrada a fases nacionales de nuestra solicitud de patente; esto implicaba que si no firmábamos un convenio, ni con ellos pero tampoco con otra empresa, se perdería su inversión. Bajo este arreglo contratamos al despacho y la empresa pagó 92 mil U$D para la entrada a fases nacionales en los países y regiones seleccionados. A partir de aquí —además de con el equipo financiero y legal— tuvimos que entendernos con el equipo de propiedad industrial de la empresa y con el despacho local contratado.
¡Por fin! la oferta de la empresa y luego… la negociación y gestión del Convenio de Licencia
Los representantes formales de la empresa nos presentaron, a finales de octubre de 2009 su propuesta de oferta mediante la ‘Hoja de términos’ y durante casi dos meses estuvimos negociando los términos principales que habrían de plasmarse en el Convenio de Licencia.
Hasta principios de 2010 finalmente recibimos la ansiada propuesta de convenio: como persona a cargo del proceso, detecté de inmediato algunas desviaciones respecto a lo plasmado en la Hoja de Términos y conceptos nuevos que no habían sido discutidos en la misma. Los siguientes días lo discutimos ampliamente con el Dr. Possani para preparar nuestra respuesta. Una semana más tarde recibimos la segunda versión del convenio, que se revisó nuevamente con detenimiento; se identificaron mejoras y nuevos ajustes en conjunto con el Dr. Possani, para preparar y enviar otra respuesta. Las revisiones continuaron a través de distintas versiones del convenio hasta que, finalmente, en mayo de ese año, llegamos a un acuerdo que honraba plenamente lo pactado en la Hoja de Términos y que presentaba opciones aceptables para aquellos puntos no incluidos en la misma. La versión final constó de 52 páginas, incluyendo un índice y una cláusula de definiciones con más de 50 términos definidos, y 3 anexos adicionales. Para dar una idea cabal de las minucias y detalles, se relatan enseguida varias que tuvimos que tomar en cuenta.
Primero, las consecuencias de la terminación por las diferentes causas posibles y los derechos y obligaciones en torno a la infracción de derechos por parte de terceros; pero además en los anexos: (a) la definición química de las moléculas que se licencian y el estatus de la propiedad industrial al momento de la firma; (b) el plan de desarrollo de la empresa para elevar la tecnología a un nivel de comercialización (con un diagrama de Gantt de 8 páginas) y que abarcaba un desarrollo a 11 años y, (c) el extracto del Registro comercial de la empresa, obtenido de la Cámara de Comercio de su país.
Epur si muove… pero hay que validarlo de acuerdo con la normatividad universitaria
Una vez completado, se envió a traducir el documento. La UNAM acepta firmar convenios en idiomas distintos al español, pero requiere de la traducción pericial para validarla y dictaminar el documento que finalmente aprueba la Dirección General de Asuntos Jurídicos (DGAJ) de la UNAM. Dos semanas después, la DGAJ respondió que el documento no se apegaba a la forma jurídica utilizada regularmente por la Máxima Casa de Estudios, porque no se presentaba una sección de declaraciones —que, aunque no venían separadas en una sección ad hoc, sí se encontraban presentes siguiendo el estilo anglosajón estándar— y que no procedía la inclusión de una sección de definiciones ni de un índice. Se recomendaba reelaborar la propuesta de convenio. Se explicó punto a punto a la abogada responsable del dictamen y emitió un nuevo dictamen, esta vez, sin hacer ningún comentario sobre la validez jurídica de los términos negociados en éste. Después de estas correcciones, ajustes y traducciones, finalmente procedimos a la firma del convenio de licencia en septiembre de 2010.
Aspectos cruciales: el modelo de negocio de la empresa
La naturaleza y métodos de cómo se ofertan bienes y servicios (en este caso de una tecnología) y la dinámica de suministros, producción, y lo que reporte ventas y utilidades a una empresa licenciataria, constituye un aspecto a tener presente en el proceso de gestión del conocimiento desde la academia. El modelo de negocio de la empresa interesada en los péptidos inmunomoduladores, se basa en adquirir licencias (mas no la propiedad de la invención) de moléculas nuevas en etapas tempranas de desarrollo, las que han sido inventadas o generadas por universidades o empresas pequeñas; como en general, estas últimas no cuentan con los recursos necesarios para invertir en el desarrollo a nivel clínico (diagnóstico, preventivo, curativo) de dichas moléculas, la empresa invierte entonces fuertes sumas de dinero de sus accionistas en el desarrollo clínico de productos basados en ellas, así como en la protección de los DPI asociados. En caso de lograr las metas de desarrollo que se planteaban, pretendían entonces sublicenciar el proyecto a empresas farmacéuticas consolidadas —conocidas convencionalmente como Big Pharma— las cuales se caracterizan actualmente por haber relegado sus procesos de investigación y desarrollo desde moléculas hasta medicamentos. En cambio buscan el tipo de negociaciones terminales que hemos ejemplificado en este relato, si no es que hasta absorben a estas empresas ‘intermedias’. Evidentemente, entre más cercano esté un producto a ser un medicamento aprobado por autoridades sanitarias, al momento de que la empresa otorgue la sublicencia a la Big Pharma, mucho mayor será el monto que recupere y las regalías que cobre. En resumen, a cambio de la licencia otorgada, la empresa intermediaria cubre a la universidad, propietaria de la molécula, pagos sujetos al logro de metas (del desarrollo clínico de la molécula) y regalías, que a su vez recupera de la sublicencia que otorga a una Big Pharma.
Los términos económicos del Convenio (los beneficios reales para la UNAM)
Si bien, por restricciones de confidencialidad no podemos divulgar aquí los términos precisos del convenio, sí es posible comentar la estructura general del mismo; aquí vamos: la empresa ofreció a la UNAM una contraprestación que incluyó siete tipos de pagos: (1) El costo asociado a la entrada a fases nacionales de la solicitud internacional de patente, en 13 países y 2 regiones seleccionados y acordados con la empresa; este monto fue superior a los 90 mil dólares y, como se dijo, lo cubrió la empresa aún antes de la firma del convenio. (2) Un primer pago ‘frontal’ (directo) a los siguientes quince días de la firma del convenio que, si bien no era tan cuantioso como lo que esperábamos, no sería el único. (3) Pagos por metas tempranas, que serían remunerados al alcanzar objetivos (´hitos´) que la empresa lograría con las moléculas descubiertas durante la fase preclínica; allí los montos casi satisfacían nuestra expectativa total. (4) Ocho pagos más, por metas avanzadas, a lo largo de las fases I, II y III de las pruebas clínicas y la aprobación regulatoria del medicamento, cuyo valor, acumulado a los anteriores era casi 10 veces más que nuestra expectativa original. (5) El pago de regalías sobre ventas netas realizadas a través de sub-licenciatarios (consistente con el plan de negocio de la empresa explicado antes), en porcentajes incrementales conforme subiera el volumen de ventas netas anuales. (6) Otros pagos de regalías sobre ventas netas realizadas directamente por la empresa o sus filiales; aunque esto se apartaba del plan de negocio de la empresa, era un escenario posible que también vaticinaba porcentajes incrementales conforme aumentara el volumen de ventas netas anuales. Finalmente (7), pagos por el otorgamiento de sublicencias, es decir, un porcentaje fijo sobre una a una de las aportaciones que la empresa recibiera en cada sublicencia otorgada.
Final cuasifeliz: La terminación del convenio y sus perspectivas
Dicen que de lo bueno poco, pues poco fue lo que duró finalmente este buen acuerdo. Año y medio después —estamos hablando de mayo de 2012— la empresa dio por terminado anticipadamente el convenio lo cual era factible, pues estaba pactada como una de las posibles causas de terminación que la parte empresarial podría, por decisión propia, detener el desarrollo de la molécula: y ese fue el caso. Fue entonces que nos devolvieron el expediente completo (conocido como dossier) con todo los reportes realizados hasta esa fecha, tal como se especificaba en el Convenio de Licencia firmado. La notificación no especificaba (desafortunadamente) ninguna razón técnica o económica que justificara esta decisión; probablemente se basaron en otros criterios de negocio, como un cambio en la línea empresarial, que en una era de fusiones (mergers) y particiones (splits) corporativas, era perfectamente explicable.
Luego de un par de meses de terminado el convenio, la empresa nos volvió a contactar para informarnos que, según sus registros de avance del proyecto, se había alcanzado a cumplir la primera de las metas tempranas, por lo requerían el envío de una factura por el monto correspondiente y hacer el pago respectivo. De esta forma fue como el proceso de este provechoso convenio de licencia de un producto biotecnológico innovador concluyó.
Haciendo un balance de todo lo ocurrido, la efímera experiencia nos permitió el financiamiento de la gestión hasta el otorgamiento de 14 de las patentes (más de 200 mil U$D en total). Esto nos dejó a todos los participantes, una gran experiencia en la gestión del conocimiento para aplicar en otros proyectos [5]. Posteriormente, gracias a la participación en una feria tecnológica organizada por la entonces Coordinación de Innovación y Desarrollo de la UNAM, se tuvo el interés de una empresa farmacéutica mexicana, a la que actualmente se ha licenciado la tecnología; desde entonces se han ocupado del desarrollo clínico de un posible biomedicamento. Los términos del convenio fueron similares, pero ajustados a nuestras condiciones normativas y operativas; los montos fueron reducidos casi en un orden de magnitud. Pero el desarrollo sigue su marcha y confiamos que pronto se llegue a aliviar la sintomatología de aquellas personas que padecen las terribles enfermedades autoinmunes (algunas imágenes muestran condiciones asociadas con la diabetes tipo II, psoriasis y esclerosis).

Figura 3. Dr. Lourival D. Possani Postay
Referencias
1. Beeton C, Chandy KG (2007) Induction and monitoring of active delayed type hypersensitivity (DTH) in rats. J Vis Exp 6:237. DOI: 10.3791/237
2. Varga Z, G Gurrola-Briones, F Papp, RC Rodriguez de la Vega, G Pedraza-Alva, RB Tajhya, R Gaspar, L Cardenas, Y Rosenstein, C Beeton, LD Possani & G Panyi, G. (2012). Vm24, a natural immunosuppressant peptide potently and selectively blocks Kv1.3 potassium channels of human T cells. Mol Pharmacol 82 (3), 372-382. DOI: 10.1124/mol.112.078006
3. Beeton C, H Wulff, NE Standifer et al. (2006) Kv1.3 channels are a therapeutic target for T cell-mediated autoimmune diseases. Proc Natl Acad Sci USA 103:17414–17419. DOI: 10.1073/pnas.0605136103
4. Possani, LD, G Gurrola-Briones, SP Salas-Castillo, CV Ferreira-Batista, Z Varga, G Panyi & R Gaspar (2007). Vm23 and Vm24, two scorpion peptides that block human T-lymphocyte potassium channels (sub-type Kv1.3) with high selectivity and decrease the in vivo DTH-responses in rats, WIPO Publication No. WO2008/139243 A1.
5. Trejo-Loyo M (2018). Guía del Instituto de Biotecnología para la redacción y registro de patentes. Disponible en: https://guiadepatentesibt.wordpress.com (consulta 29-nov-22)
Comparte este artículo en redes sociales

Acerca de los autores
El I.Bq.I. y M. en A. Mario Trejo Loyo, es Secretario Técnico de Gestión y Transferencia de Tecnología dentro de la Secretaría de Vinculación del IBt, y es el encargado de todo lo relativo a los derechos de propiedad intelectual de los proyectos de I&D. El autor y los editores extendemos un reconocimiento al Dr. L.D. Possani por el impulso a nuestras labores y un reconocimiento por el reciente otorgamiento de un nuevo Doctorado honoris causa de la UNAM.
Contacto: mario.trejo@ibt.unam.mx
Estudios electro-fisiológicos: experimentos para medir indirectamente cambios en
variables eléctricas en sistemas biomoleculares que semejan el interior y el exterior de las
células; constan de compartimentos separados por membranas donde se insertan los llamados ‘canales
iónicos’ que sirven como pasajes de moléculas cargadas; los canales se ‘abren’, se ‘cierran’ o
modifican su conductividad (mediciones en el rango nAmp), dependiendo de la presencia de ciertos
componentes, tales como algunas fracciones purificadas de los venenos.
La inmunomodulación es la manipulación de manera específica de las
respuestas de nuestro sistema de defensa que actúa contra agentes extraños (virus bacterias o
tumores), pero que en ocasiones genera efectos adversos como inflamaciones excesivas, rechazo de
trasplantes o enfermedades autoinmunes, que pueden ser moduladas (reguladas) por efectores
moleculares específicos.
Fases nacionales: Las solicitudes internacionales (PCT) están vigentes como tales
por un máximo de 30 meses desde el día de la solicitud, al término del plazo la solicitud queda
abandonada, a menos que se gestionen una o más solicitudes nacionales de patente, las que
eventualmente podrán convertirse en patentes otorgadas.
La Hoja de Términos es un documento no-vinculante y confidencial, donde se
establecen los principales aspectos a ser discutidos en la negociación, tales como la definición de
la tecnología a licenciar, los alcances de la licencia (territorialidad, exclusividad, producto a
ser comercializado y su campo de uso, otorgamiento de sublicencias), la responsabilidad del
desarrollo subsecuente de la tecnología, la gobernanza del convenio, la propiedad industrial
asociada original y subsecuente, las contraprestaciones a cubrir por parte de la empresa, la
vigencia y causas de terminación del convenio, confidencialidad y la legislación aplicable.






